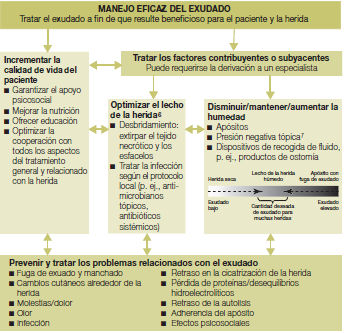
Manejo de la herida con el fin de acelerar la curación endógena o para acelerar la efectividad de otras medidas terapéuticas. Permite eliminar todas las barreras que impiden o estancan la cicatrización de las heridas.

El marco TIME para la valoración de la úlcera de pie diabético, permite hacer un diagnóstico rápido de las condiciones del lecho de la herida a fin de decidir el tratamiento. Orienta acerca de los pasos que se deben seguir para conseguir la cicatrización de la úlcera.
Los pilares de la preparación del lecho de la úlcera de pie diabético es la limpieza, descontaminación, desbridamiento, control del biofilm bacteriano y gestión del exudado. En las heridas crónicas, hay que considerar que más del 90% de ellas contiene biofilm y éste biofilm es el responsable de mantener la lesión estancada en la fase inflamatoria del proceso de cicatrización.
Protocolo de curación avanzada en úlcera de pie diabético: TIMERS EN PRÁCTICA
RESCATE DEL PIE DIABETICO A TRAVÉS DE LA CURACIÓN AVANZADA DE HERIDAS
ENFOQUE INTEGRAL Y CENTRADO EN EL PACIENTE
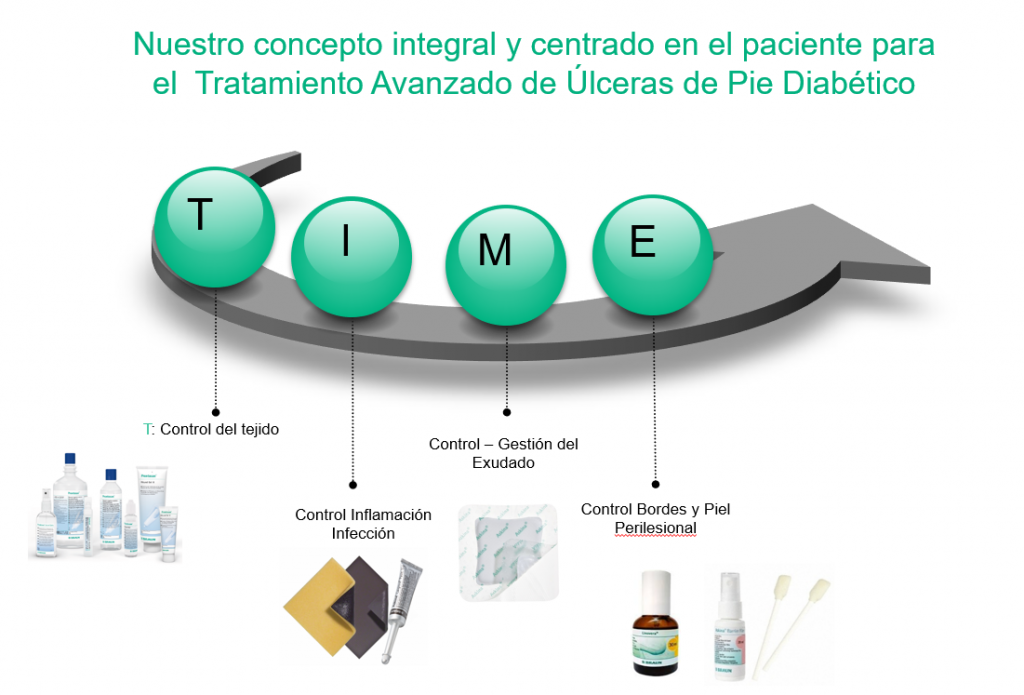
T : CONTROL DEL TEJIDO NO VIABLE
- Retiro de vendajes y apósitos
- Realizar el retiro de vendajes y apósitos utilizando guantes de procedimiento y previa higiene de manos con alcohol-gel o con agua y jabón. Los apósitos con abundante contenido purulento y sangre deben ser eliminados en desechos especiales y el resto en residuos domésticos. Se debe observar el apósito a fin de determinar calidad y cantidad de exudado.
- Identificar la localización, la longitud, la anchura y la profundidad de la úlcera para clasificarla
- Limpieza y desbridamiento de la herida
Como es bien sabido, todas las heridas están contaminadas y las heridas crónicas en un 90% contienen biofilm bacteriano. Como la herida se encuentra estancada en la fase inflamatoria del proceso de cicatrización, hay incremento de la permeabilidad vascular y abundante salida de exudado. Éste exudado contiene mediadores inflamatorios liberados en el lecho a fin de eliminar el biofilm. El exudado por tanto, es rico en Metaloproteasas, enzimas que degradan proteínas especialmente el colágeno lo que contribuye con el retraso en la cicatrización. La presencia de tejido desvitalizado y/o necrótico dificulta la cicatrización por lo que se hacer necesario eliminar esos tejidos con el objetivo de lograr un lecho con tejido granulatorio en un 100%.
La limpieza de la herida sería el paso #1 en la preparación del lecho. Las soluciones de limpieza tradicionales son la solución fisiológica, el agua estéril e incluso el agua del grifo. Estas soluciones para irrigación y arrastre mecánico no tienen ningún efecto sobre el biofilm bacteriano, por lo que para su manejo se sugiere la utilización de otros productos.
El lavado de la herida puede ser con agua y jabón neutro y una esponja. Se lava vigorosamente la herida, bordes y piel perilesional que también presentan una elevada carga bacteriana. El lavado se realizará desde lo más limpio a los más contaminado, es decir de arriba hacia abajo.
- Arrastre mecánico:
La técnica a elección para la limpieza será el arrastre mecánico con solución fisiológica. Se realizara por duchoterapia o con jeringa y aguja. Las presiones de ambas oscilan entre 1 – 4kg/cm2 y éstas son las presiones ideales que no dañan a las células que participan en el proceso de cicatrización.
A- Duchoterapia artesanal: se debe perforar un matraz de solución fisiológica con aguja 19-21 previa desinfección del matraz con alcohol 70%. Las perforaciones serán entre 15 a 25 orificios.
Fundación INH https://inheridas.cl/wpcontent/uploads/2017/03/MuestraGuiaPie2012.pdf
B- Arrastre con jeringa: de preferencia usar jeringa de 20 a 35 cc con aguja 19. Colocar la jeringa a unos 15 cm de la lesión e iniciar la irrigación de la solución fisiológica. Éste procedimiendo se recomienda para heridas de menos de 5cm de tamaño.

Limpiadores de piel en espuma:
En la actualidad existen disponibles limpiadores en espuma con pH neutro, creatina, ácidos grasos y emolientes que facilitan la limpieza de la piel. Solo puede utilizarse en piel. No necesita enjuague.
Sin embargo para el lavado o limpieza de la piel bastaría con lavar con un jabón de pH neutro y enjuagar con abundante solución fisiológica.
Clorhexidina jabonosa 2%: después de la irrigación con solución fisiológica, algunos clínicos realizan el lavado de la herida con clorhexidina jabonosa al 2%. La clorhexidina es un antiséptico con amplio espectro antimicrobiano que se ha utilizado con el fin de reducir carga bacteriana en el lecho de la herida. Sin embargo, no es selectivo y daña las células que participan en el proceso de cicatrización al ser citotóxico y también daña la piel perilesional. Comienza a actuar al los tres minutos de aplicado y tiene un efecto residual de seis horas. Hay que asegurarse retirar toda la clorhexidina jabonosa del lecho de la herida, bordes y piel perilesional a fin de evitar retraso en el proceso de cicatrización. Solo aplicarla una vez por semana.
RECOMENDACIÓN: no Clorhexidina de manera rutinaria
Polihexanida Betaína 0,1% : solución de limpieza y descontaminación de heridas. Recomendada para el control y prevención del biofilm bacteriano con acción desbridante y antimicrobiana selectiva. Ver en control de inflamación e infección.
Toma de cultivo: necesario para hacer un diagnóstico microbiológico más preciso en infecciones profundas ya que comúnmente la superficie de la lesión está colonizada por tres o más microorganismos. El cultivo debe ser anaerobio y aerobio. La muestra se toma después del arrastre mecánico y con técnica aséptica. Si existe tejido desvitalizado y necrótico la muestra se toma después del desbridamiento de la zona que contiene el tejido necrótico. El tamaño de la muestra es de aproximadamente 0,5 cm y se utiliza una pinza, una cureta o un bisturí. El trozo de tejido se coloca en placa de Tioglicolato en el que crecen anaerobios y aerobios. Se transporta al laboratorio en un tubo con hisopo dentro de 72 horas como máximo.
Una alternativa al cultivo es el aspirado del exudado con jeringa, la muestra deberá ser enviada inmediatamente al laboratorio, cerrada y sin burbujas.
Desbridamiento
Todo tejido no viable necrótico o esfacelado genera un retraso en el proceso de cicatrización y representan un caldo de cultivo para el desarrollo de microorganismos. Eliminar estos tejidos es de vital importancia para acelerar el proceso de cicatrización.
A través del desbridamiento se elimina tejido no viable avascularizado, biofilm y otros detritos que estancan la cicatrización. El desbridamiento contribuye con la formación de tejido de granulación.
El desbridamiento se define como mecanismo fisiológico o proceso externo (quirúrgico –mecánico) en el que ocurre el retiro o eliminación de todos los tejidos no viables del lecho de la herida.
Reducción de callosidades: El desbridamiento de callos puede reducir significativamente la presión en el lugar del callo en aproximadamente un 30% (Pitei, Foster & Edmonds, 1999; Young et al., 1992).
| Recomendaciones basadas en la evidencia para el desbridamiento de heridas |
|---|
| El tejido necrótico o desvitalizado representa un obstáculo para el proceso de cicatrización. Aumenta la probabilidad de infección. Para lograr la cicatrización de la úlcera es necesario retirar estos tejidos a través del desbridamiento |
| En presencia de compromiso vascular (isquemia) el desbridamiento está contraindicado. Precaución en pacientes con coagulopatías o en tratamiento anticoagulante. Siempre realizar una valoración integral del paciente antes de realizar desbridamiento mecánico-quirúrgico |
| Limpieza- descontaminación y desbridamiento de la herida minimizan la colonización crítica de la úlcera y minimiza el riesgo de infección. Se elimina el biofilm |
| La elección del método de desbridamiento depende de la condición clínica del paciente y de la herida, del juicio clínico y de los recursos disponibles |
TIPOS DE DESBRIDAMIENTO
Existen diferentes tipos de desbridamiento y como señalé anteriormente la elección de un método u otro depende de la condición clínica del paciente, de la valoración del lecho y de los recursos disponibles.
Desbridamiento quirúrgico: eliminación del tejido necrótico- desvitalizado utilizando un bisturí, cureta o tijera. Procedimiento realizado en quirófano o en sala de procedimientos. Recomendado en UPD infectadas o en aquellas que tengan una cantidad mayor o igual a 25% de tejido no viable. Método rápido y efectivo pero no selectivo ya que también se eliminan tejidos o dermis viable y además vasos sanguíneos. El desbridamiento quirúrgico y la toma de cultivos deberán ser realizados por médico o enfermera (o) entrenada (o). El profesional de enfermería está habilitado para realizar desbridamiento quirúrgico hasta el tejido subcutáneo.
Desbridamiento autolítico: es el debridamiento que ocurre al proporcionar humedad al lecho de la herida. Esa humedad activa a las propias células del organismo para que inicien el desbridamiento. Se utilizan hidrogeles, apósitos hidrocoloides o films de poliuretano transparentes con adhesivo. Estos productos que al entrar en contacto con el lecho crean un ambiente húmedo que estimula la autolisis de los tejidos no viables por autodigestión (por acción de macrófagos y leucocitos polimorfonucleares y por la activación de enzimas proteolíticas que degradan el tejido necrótico y desvitalizado que luego se elimina con el arrastre mecánico.
El desbridamiento autolítico con HIDROGELES es un método costo-efectivo, simple, indoloro y es el recomendado para el manejo de UPD.
El desbridamiento con hidrocoloides o transparentes adhesivos NO SE RECOMIENDA EN UPD ya que son oclusivos y ninguno de los dos está recomendado si hay signos de infección o altos niveles de exudado.
Desbridamiento hiperosmótico: eliminación de tejidos no viables por diferencia de osmolaridad. El producto aplicado sobre el lecho posee alta osmolaridad por lo que ocurre absorción de exudado y de esa manera ocurre el desbridamiento. Los productos disponibles son: apósitos de Ringer, de miel y con PHMB. Para UPD con colonización crítica se recomienda el de Ringer y PHMB.
Desbridamiento autolítico e hiperosmótico se realizan después del desbridamiento quirúrgico o en lesiones con menos del 25% de tejido desvitalizado.
TIME
I: CONTROL DE LA INFLAMACIÓN Y DE LA INFECCIÓN
La carga bacteriana es la concentración de gérmenes por gramo de tejido de la lesión, considerando carga bacteriana aumentada si es igual o superior a 105 unidades formadoras de colonias por gramo de tejido.
Como señalé al principio del documento, la carga bacteriana en una herida o úlcera se puede presentar en cuatro estadios: heridas contaminadas, colonizadas, con colonización crítica o infectadas.
INFLAMACIÓN:
Ya señalamos que debido a la presencia del biofilm bacteriano la herida se encuentra estancada en la fase inflamatoria del proceso de cicatrización. Podríamos representar la presencia del biofilm con la COLONIZACIÓN CRÍTICA. La inflamación crónica persistente puede o estar acompañada de signos locales o sistémicos de infección (en los casos más graves).
CELULITIS Y OSTEOMIELITIS
Celulitis: Las infecciones del pie diabético que representan una amenaza para la extremidad pueden presentar celulitis que se extiende 2cm más allá del borde de la herida, con signos básicos de infección como fiebre, edema, linfangitis, hiperglucemia, leucocitosis, y/o isquemia (Frykberg et al., 2000).
La celulitis se puede manifestar como:
- Infección local de la úlcera
- Celulitis en extensión
- Escarificación del la úlcera
- Compromiso vascular de la piel: en éste caso la falta de oxigenación al tejido genera una coloración azul.
Un paciente que presente gangrena húmeda, abscesos profundos y celulitis avanzada debe transferirse a un centro médico para atenderle con urgencia.
Indicadores de infección en úlcera de pie diabético
- Base de la úlcera gris amarillenta
- Decoloración azul de los tejidos circundantes
- Fluctuación (tejido blando) o crepitación (crepitante, chirriante) al tacto
- Exudado purulento
- Escarificación de la úlcera y tejido circundante
- Senos con afectación o exposición del hueso
- Formación de abscesos
- Mal olor
- Resquebrajamiento de la herida
- Retardo en la cicatrización
Una úlcera que afecta al hueso o la articulación es un importante factor de predicción de osteomielitis (Grayson et al., 1995)
Si al introducir una sonda estéril en la úlcera, se alcanza el hueso, esto indica osteomielitis.
IMPORTANTE: La aplicación de apósitos que retienen la humedad en el contexto de la isquemia y/o gangrena seca puede producir una grave infección que amenace a toda la extremidad o a la vida del paciente.
Extraído de: Tratamiento del Biofilm. Documento de Consenso Sociedades Internacionales de Heridas
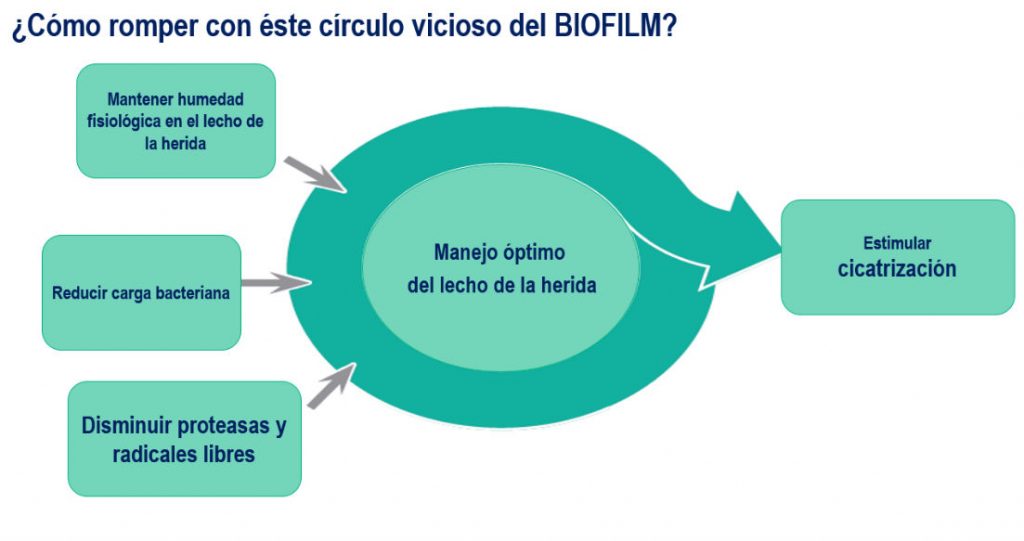
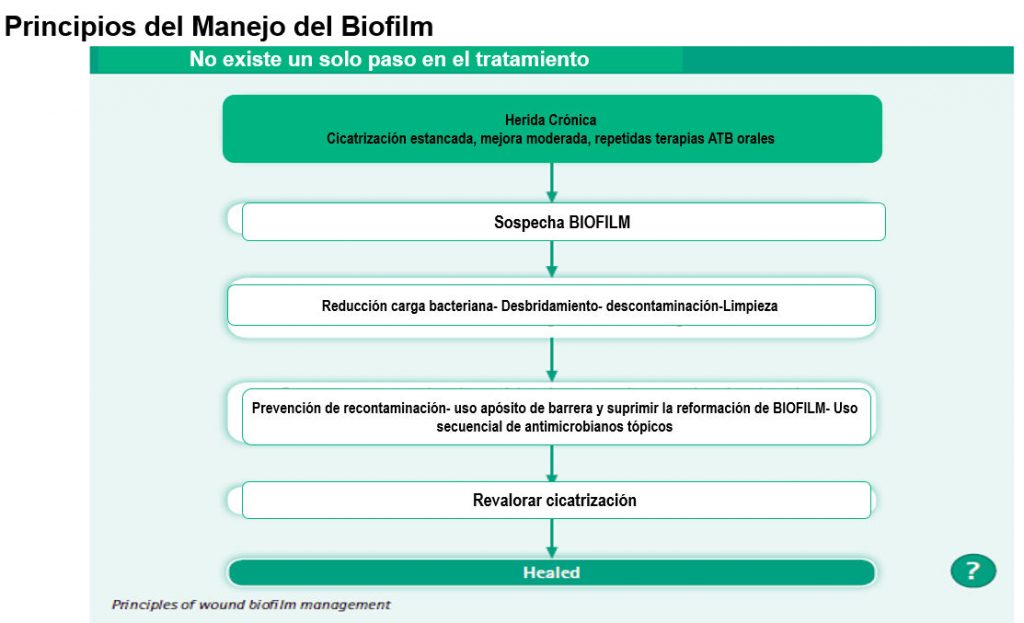
La preparación del lecho de la herida permite el control del biofilm bacteriano y por ejemplo la polihexanida en gel dejada en el lecho previene la reorganización del biofilm asegurando con ellos una mejoría en las condiciones generales de la herida.
Al controlar y prevenir la formación de biofilm dejando en el lecho algún antimicrobiano tópico NO ANTIBIÓTICO, la fase inflamatoria baja en intensidad y con ellos bajan los niveles de mediadores inflamatorios en el lecho (enzimas proteolíticas, metaloproteasas etc.) a la vez que se reduce el nivel de exudado (la inflamación produce un incremento de la permeabilidad vascular y con ello un incremento de la fuga de exudado).
Polihexanida con betaína al 0,1%: indicado para la limpieza, descontaminación, control y prevención del biofilm bacteriano. La polihexanida es una bactericida de amplio espectro antimicrobiano que actúa incluso contra bacterias multirresistentes productoras de biofilm. Es selectiva en su acción ya que provoca la muerte de la bacteria sin dañar las células que participan en el proceso de cicatrización logrando promover el cierre temprano de la úlcera. La betaína debe estar en contacto con el lecho de la herida por un máximo de 15 minutos para lograr romper la estructura del biofilm y dejar expuestas a las bacterias a la acción de la polihexanida. (The role of surfactants in mechanical debridement file:///C:/Users/Public/LOCAL/descargas/role-surfactants-mechanical-debridement%20(1).pdf)
Se utiliza empapando una gasa estéril o compresas estériles y se cubre todo el lecho de la herida y los bordes por 10 a 15 minutos. Luego con la misma gasa se realiza un arrastre mecánico suave y con éste movimiento se eliminan los tejidos que hayan sido ablandados por la acción de la betaína. También puede utilizarse una pinza para eliminar los detritus que desprende el producto o proceder con el desbridamiento quirúrgico. La betaína por tanto realiza un desbridamiento surfactante. La Polihexanida- Betaína no se enjuaga. No tiene efecto residual por lo que se recomienda dejar Polihexanida- Betaína en gel, que provee humedad que favorece el desbridamiento autolítico a la vez que se controla la formación de biofilm. El gel puede quedar en el lecho hasta 72 horas.
El control del biofilm es clave para bajar el metabolismo de la herida (fase inflamatoria) y reestablecer la homeostasis en el lecho de la herida lo que favorece el proceso de cicatrización.
De acuerdo al último consenso en wounds antisepsis 2018 NO HAY evidencia de resistencia.
(https://pdfs.semanticscholar.org/352f/46f6e53f24455389ab913d2d9a9702e0e538.pdf).
IMPORTANTE: La Polihexanida-Betaína NO ES UN ANTISÉPTICO, es un dispositivo médico que actúa en el lecho de a herida. No tiene absorción sistémica. Puede ser usado en heridas colonizadas, colonizadas críticamente o infectadas. Contraindicado su uso en cartílago hialino estéril.
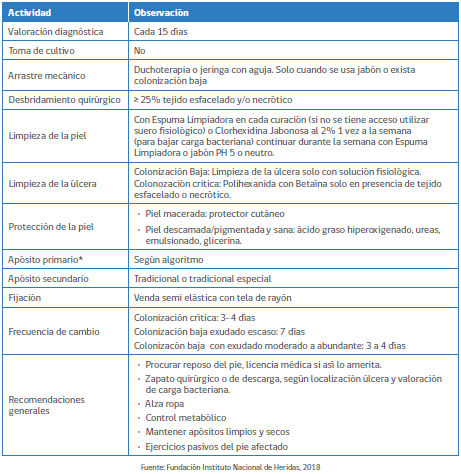
El siguiente cuadro fue extraído de la Orientación Técnica para el Manejo Integral de la UPD del MINSAL 2018. Son recomendaciones de expertos nacionales, entre ellos la Fundación Instituto Nacional de Heridas.
Recomendaciones para manejo de UPD NO INFECTADO
Importante
De acuerdo a mi experiencia y a las recomendaciones internacionales basadas en la evidencia en relación a la utilización del clorhexidina jabonosa al 2% para la limpieza de la piel sugiero no utilizarla ya que es citotóxica y daña la piel perilesional. Mi sugerencia es lavar la piel del paciente con agua y jabón neutro, arrastre mecánico con solución fisiológica.
Algoritmo para manejo de UPD NO INFECTADO
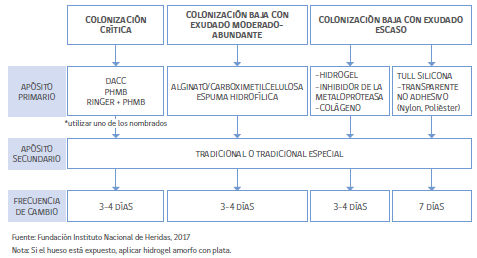
En heridas con colonización crítica se recomiendan apósitos bacterióstaticos
Gasa con Cloruro de Diaquil Carbamoilo DACC: gasa tejida o gasa de acetato impregnada en Diaquil Carbamoilo, sustancia hidrófoba que repele el agua y que le da una coloración verde al apósito. Los microorganismos que habitualmente colonizan las heridas poseen componentes hidrófobos. Los componentes hidrófobos se atraen entre si y por esta razón al colocar el apósito en el lecho y con la absorción del exudado las bacterias quedan adheridas al apósito. Al retirar el apósito, se van las bacterias adheridas a el. Frecuencia de cambio cada 3-4 días.
Gasa con Polihexametileno-Biguanida (PHMB): Biguanida. De acuerdo al fabricante, impide el crecimiento bacteriano y es efectivo contra las bacterias que habitualmente colonizan las heridas. Frecuencia de cambio cada 3-4 días.
Apósito Ringer + PHMB: apósito almohadillado con varias capas que contiene solución Ringer en alta concentración que se libera al lecho y facilita desbridamiento. Contiene PHMB que actúa contra bacterias. Frecuencia de cambio cada 3-4 días.
Protocolo de curación avanzada en UPD INFECTADA

Si la UPD está infectada, se utilizarán apósitos de bactericidas a base de plata:
Apósitos curación avanzada UPD infectado
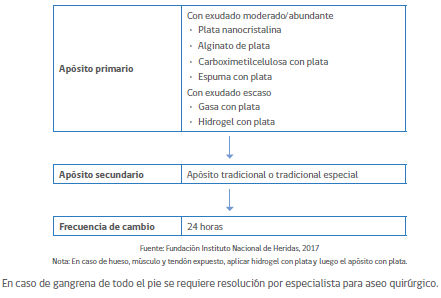
Plata Nanocristalina: gasa no tejida de rayón con poliéster con cubierta de polietileno en ambas caras y recubierta con plata nanocristalina. Esta es plata metálica que debe ionizarse (perder un electrón) para convertirse en plata iónica con capacidad bactericida. La plata metálica en contacto con el exudado de la herida o con agua bidestilada forma oxido de plata soluble en agua y que en contacto con el exudado o el agua se transforma en plata iónica. La activación de plata metálica debe hacerse con agua bidestilada, exudado o hidrogeles, NUNCA con solución fisiológica ya que precipita la plata.
Alginato con plata: fibras de alginato de calcio recubiertas con plata iónica. El alginato absorbe el exudado y los iones de plata localizados entre las fibras de alginato son liberados para ejercer su acción bactericida. Usados en heridas altamente exudativas
Espuma con plata iónica: espuma de poliuretano hidrófila que contiene una matriz de alginato de calcio más plata iónica. No requiere activación ya que la plata viene en estado iónico con capacidad bactericida al momento de entrar en contacto con el lecho de la herida. Al contacto con el lecho de la herida, el exudado es absorbido por la espuma. Se produce un intercambio de los iones Sodio del exudado y de los iones plata que se desprenden gradual y sostenidamente desde la matriz. Usados en heridas altamente exudativas.
Carboximetilcelulosa sódica con plata Iónica: las bacterias se adhieren al apósito que contiene plata iónica con acción bactericida.
Gasa con plata: Gasa no tejida de algodón de baja adherencia. Sus fibras están recubiertas con Sulfato de Plata altamente soluble. Necesita activarse con agua bidestilada o con el exudado para convertirse en plata iónica.
Hidrogel o pasta con plata: gel amorfo que contiene agua, plata iónica, alginato, polisacáridos y aceites. Permite hidratar la herida a la vez que mata bacterias.


Extraído de: Cura en ambiente húmedo de heridas crónicas a través del TIME. Tizón –Bouza E. Revista DIALNET 2013. Disponible en:
RECOMENDACIONES USO DE APÓSITOS DE PLATA
- Todos los apósitos de plata mencionados se pueden recortar
- Aplicar el apósito sobre el lecho de la herida y no sobre la piel ya que pueden teñir
- La tinción del lecho de la herida es inocua y transitoria. Se elimina con los lavados y el desbridamiento
- Los apósitos de plata han sido diseñados para liberar gradual y sostenidamente los iones plata en el lecho
- Los fabricantes de apósitos de plata aseguran una liberación de iones plata durante 7 días
- Activar apósitos de plata nanocristalina (metálica) con agua bidestilada o con el exudado
- La solución fisiológica puede hacer precipitar los iones plata
- De acuerdo a la guía del uso prudente de apósitos de plata, estos pueden ser usados de manera profiláctica (ejemplo colonización o colonización crítica)
- Si la herida está infectada, el cambio de apósito es cada 24 horas si es altamente exudativa (etapa aguda). Después curaciones cada 48 a 72 horas
- Retirar el apósito antes de scanner o resonancia magnética nuclear
- Iniciar curaciones con un apósito con alta carga de iones plata
- Suspender tratamiento una vez controlada la infección
- Reiniciar si reaparecen signos de infección y de acuerdo a juicio clínico
| Glosario de términos Unidad 7 | |
|---|---|
| Curación avanzada UPD | Es aquella en que se mantiene humedad fisiológica para fomentar el proceso de cicatrización. Para ello se utilizan apósitos interactivos, bioactivos y/o mixtos. La curación tradicional que se realizaba en medio seco con la formación de costra genera un retraso en el proceso de cicatrización. La curación tradicional se realiza con solución fisiológica y gasas y apósitos tradicionales pasivos |
| Marco TIME | Acrónimo. Herramienta práctica para valorar la herida/úlcera. T: control del tejido, I: control de la inflamación-infección, M (moisture): control de la humedad, E: (edges) control de los bordes y piel perilesional |
| Preparación del lecho de la herida | Enfoque global para la eliminación de obstáculos en la cicatrización y para la estimulación del proceso de cicatrización. Es un concepto dinámico que debe adaptarse a las necesidades de la herida y al proceso de cicatrización |
| Biofilm | Los biofilms son comunidades bacterianas inmersas en una matriz extracelular compuesta por diversas sustancias poliméricas. Son resistentes a las defensas del huésped y a los antibióticos |
| Metaloproteasas | La metaloproteinasa o metaloproteasa es una enzima que genera proteólisis (proteasas) |
Callosidad | Zona de la piel anormalmente gruesa o dura, normalmente causada por una presión o rozamiento continuos, a veces sobre una prominencia ósea. |
Celulitis | Infección de la piel caracterizada habitualmente por calentamiento local, enrojecimiento (eritema), dolor e hinchazón |
| Absceso | Una acumulación limitada de pus que se forma en el tejido como resultado de una infección aguda o crónica localizada. Está asociada con la destrucción de tejidos y una inflamación frecuente |
| Antimicrobiano | Agente que se utiliza para matar bacterias o microbios, no sintetizado a partir de un organismo vivo (como yodo o plata) |
| Antiséptico (tópico) | Producto con actividad antimicrobiana concebido para utilizarlo en la piel u otros tejidos superficiales; puede dañar células |
| Infección | Presencia de bacterias u otros microorganismos en cantidad suficiente para dañar los tejidos o entorpecer la cicatrización. La experiencia clínica indica que las heridas se pueden clasificar como infectadas cuando el tejido contiene 105 o más microorganismos por gramo de tejido. Los signos clínicos de la infección pueden no aparecer, especialmente en pacientes con inmunodeficiencia o con heridas crónicas |
TIME
M: CONTROL DEL EXUDADO
Objetivo:
- Conocer la importancia del exudado y del manejo de los bordes epiteliales para lograr la cicatrización de la úlcera
- Adquirir nociones básicas de los dispositivos de descarga y del manejo del paciente después de una amputación
Objetivos específicos:
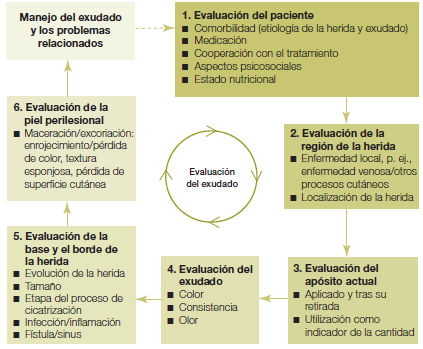
- Aplicar valoración TIME para determinar calidad y cantidad de exudado y calidad de los bordes epitelizales y piel perilesional y elección del apósito
- Describir componentes del exudado y sus ventajas y desventajas
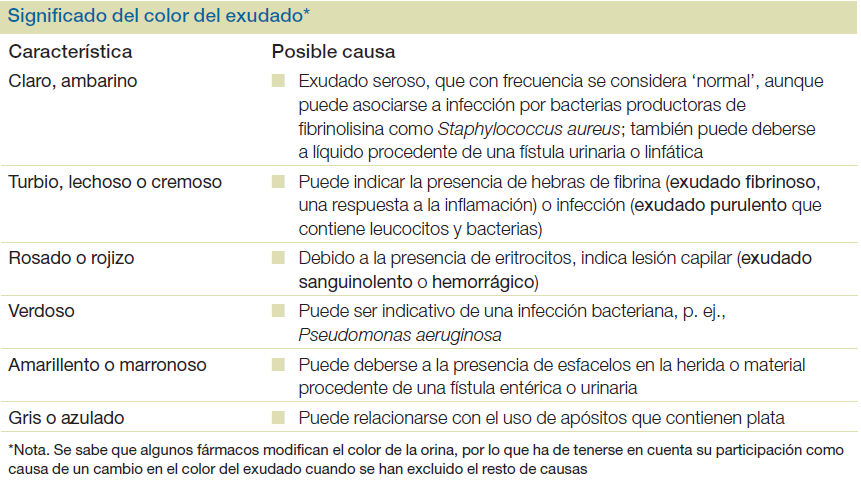
- Describir el significado del color del exudado
- Enumerar los diferentes apósitos para la gestión del exudado
- Distinguir las diferentes formas de gestión del exudado de los apósitos
- Describir las consideraciones para la elección de apósitos
- Categorizar los diferentes productos protectores e hidratantes para el manejo de los bordes y piel perilesional
- Conocer los diferentes tipos de descargas
- Conocer cuidados generales del paciente amputado
La curación de heridas en ambiente húmedo fisiológico tiene numerosas ventajas:
- Fase inflamatoria menos intensa y menos prolongada
- Estimula la Proliferación, diferenciación temprana y migración acelerada de queratinocitos para restaurar la función de barrera del estrato córneo.
- Incrementa la proliferación de fibroblastos
- Incrementa la síntesis de colágeno
- Promueve angiogénesis temprana y menos prolongada
- Temprana contracción de la herida de espesor total
Extraído de: Debbie Sharman. Moist Wound Healing: a review of evidence, application and outcome. Disponible en: https://www.diabetesonthenet.com/uploads/resources/dotn/_master/2381/files/pdf/df6-3-112-20.pdf
Sin embargo, la humedad excesiva en el lecho de la herida genera maceración de los bordes y de la piel perilesional. En el otro extremo, la falta de exudado deseca el lecho de la herida y los bordes lo que también retarda el proceso de cicatrización. El objetivo del control del exudado es lograr una humedad fisiológica, un equilibrio en la humedad que permita a la herida avanzar en el proceso de cicatrización.
¿De dónde proviene el exudado?
El exudado deriva del líquido que se fuga de los vasos sanguíneos y que entra en la herida y no puede ser reabsorbido.
El exudado ayuda en la cicatrización al:
■ Evitar que se seque el lecho de la herida
■ Ayudar en la migración de las células reparadoras de tejidos
■ Aportar nutrientes esenciales para el metabolismo celular
■ Permitir la difusión de factores inmunitarios y de crecimiento
■ Ayudar a separar el tejido desvitalizado o lesionado (autólisis).
Herida crónica, estancada en la fase inflamatoria, persistencia en la producción de exudado. El exceso y la falta de exudado interfieren con el proceso de cicatrización.
Componentes del exudado
El exudado contiene agua, electrolitos, nutrientes, mediadores inflamatorios, células de la serie blanca, enzimas proteolíticas (MMP), factores de crecimiento y productos de desecho.
Sus características físicas proporcionan una buena idea del estado de la herida: color, aspecto, cantidad, viscosidad, olor.
La cantidad de exudado relacionado con: tamaño y con la fase de cicatrización (periodo inflamatorio y escaso hacia el final de la proliferación)
- En la evaluación del exudado lo más importante son las variaciones de sus características.
- Los apósitos manchados aportan indicaciones vitales sobre el exudado
| Significado de la consistencia del exudado | |
|---|---|
| Alta viscosidad (espeso, pegajoso en ocasiones) | Alto contenido proteico debido a infección o proceso inflamatorio. Presencia de material necrótico. |
| Baja viscosidad (líquido) | Bajo contenido proteico debido a: enfermedad venosa o cardiopatía congestiva |
Ambas tablas extraídas de: El exudado en las heridas y rol de los apósitos. https://gneaupp.info/wp-content/uploads/2014/12/exudado-en-las-heridas-y-utilidad-de-los-apositos.pdf
Efectos negativos del exudado
- Una falta o exceso de exudado puede tener un efecto negativo sobre la proliferación y migración celulares
- Los mediadores inflamatorios pueden estar elevados y contribuir al retardo de la cicatrización
- El nivel de metaloproteasas MMP activadas puede estar alto y contribuir al retardo de la cicatrización
- En exceso el exudado aumenta el riesgo de maceración de la piel peri-ulcerosa
Evaluación del exudado
¿Cómo se logra una cicatrización en ambiente húmedo fisiológico?
La cicatrización de heridas en ambiente húmedo fisiológico se logra con la utilización de apósitos que gestionan eficientemente el exudado de la herida.
Características de los apósitos para la gestión del exudado
- Aportan equilibrio térmico
- Permiten el intercambio de oxígeno
- Eliminan y controlan exudado
- Curas más fáciles y sencillas
- Mejor relación coste/beneficio: al disminuir la frecuencia de las curaciones ya que pueden permanecer en el lecho de la herida por más tiempo
Rippon Marck. Wound hydratation versus maceration. file:///C:/Users/Public/LOCAL/descargas/wound-hydration-versus-maceration-understanding-the-differences.pdf
Tratamiento con apósitos para la gestión eficiente del exudado
MECANISMO DE ACCIÓN DE LOS APÓSITOS
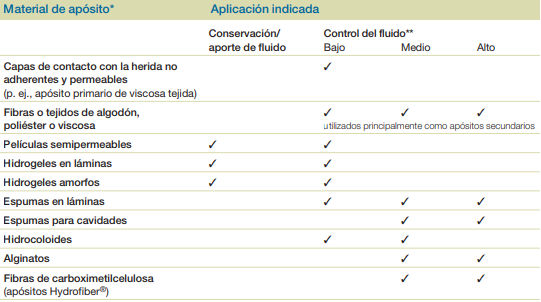
- Absorción: el líquido penetra en los materiales del apósito por difusión y por atracción hacia los espacios (acción capilar o ‘efecto de mecha’). Los apósitos absorbentes sencillos, p. ej., espumas y textiles de algodón, viscosa o poliéster, mantienen el líquido en los espacios de su estructura a modo de esponja.
- Evaporación/transmisión: muchos apósitos absorbentes poseen la habilidad de permitir que el exudado de la herida se evapore al traspasar su membrana semipermeable. Esta capacidad del apósito se puede medir como la TASA DE TRANSMISIÓN DE VAPOR (TTVH). Esta característica se cuantifica como la tasa de transmisión de vapor húmedo (TTVH). Existen apósitos que tienen una mayor o menor TTVH y su elección entonces depende de la cantidad de exudado y de los objetivos del tratamiento.
- Retención de líquido: los apósitos interactivos, p. ej., hidrocoloides, alginatos y fibras de carboximetilcelulosa (CMC), captan líquido y forman un gel que retiene el líquido..
- Bloqueo de componentes del exudado: los estudios in vitro han demostrado que algunos apósitos, p. ej., fibras de CMC y algunos alginatos, atrapan bacterias y componentes del exudado, como enzimas, en un proceso denominado bloqueo . Parece que este bloqueo es mayor en los materiales que producen un gel cohesivo uniforme, tales como las fibras de CMC (carboximetilcelulosa). Se precisa una evaluación más detallada de la repercusión clínica de este efecto.
Extraído de: El exudado en las heridas y rol de los apósitos. https://gneaupp.info/wp-content/uploads/2014/12/exudado-en-las-heridas-y-utilidad-de-los-apositos.pdf
CRITERIOS PARA ELEGIR UN APÓSITO Debe mantener un microambiente fisiológico húmedo que favorezca la granulación.
Debe ser capaz de mantener una barrera que aísle la lesión del medio ambiente y la proteja de contaminación y traumatismos
Debe mantener un ambiente térmico fisiológico
Debe permitir el intercambio gaseoso de la herida con su entorno.
Debe permitir una adecuada circulación sanguínea
Debe facilitar la eliminación de secreciones y ser capaz de absorberlas.
Debe ser adaptable, flexible y de fácil manipulación
Debe estar libre de contaminantes tóxicos o partículas
Debe poseer un adhesivo que no dañe la piel circundante ni el tejido de granulación.
Debe permitir ser retirado sin trauma ni dolor para el paciente.
Debe favorecer la remoción de tejidos necrótico y/o esfacelado sin dañar el tejido granulatorio
Evaluación del exudado y su interacción con el apósito
| Situación apósito | Indicadores |
| Seco | Lecho de la herida seco. No hay humedad visible. El apósito primario no está manchado y puede estar adherido al lecho. |
| Húmedo | Pequeñas cantidades de líquido visibles cuando se retira el apósito. Apósito primario ligeramente manchado. Esta sería la condición ideal del lecho de la herida. Una humedad equilibrada. |
| Mojado | El apósito primario se encuentra muy manchado, pero no hay paso de exudado desde el apósito al exterior |
| Saturado | Apósito primario mojado y hay traspaso de exudado. La piel perilesional y bordes pueden estar macerados |
| Con fuga de exudado | Apósitos saturados y hay fuga de exudado desde apósito primario y secundario hacia el exterior de la herida, puede mojar incluso la ropa del paciente. Bordes y piel perilesional macerada. |
Tipos de apósitos para la gestión del exudado
Apósitos utilizados en Chile
En Chile los apósitos de utilizan de acuerdo a la clasificación de Turner quien los divide en: apósitos interactivos, bioactivos y mixtos. Algunos apósitos interactivos se usan como apósitos primarios o como protectores de piel.
CLASIFICACIÓN DE LOS APÓSITOS
En la actualidad, se clasifican en: Apósitos Pasivos
Apósitos Interactivos
Apósitos Bioactivos
Apósitos Mixtos
APÓSITOS PASIVOS
Son apósitos simples y de bajo costo. Sirven principalmente para proteger, aislar, taponar y absorber
Pertenecen a esta categoría tres tipos de apósitos: Gasa
Apósito tradicional
Espuma tipo Moltoprén
APÓSITO BIOACTIVO
Poseen la característica de interactuar con la herida. Están diseñados para mantener una humedad fisiológica en la herida o úlcera y permitir la oxigenación.
Existen 3 tipos: Hidrocoloides
Hidrogel
Alginatos
APÓSITOS MIXTOS
Son apósitos con diferentes niveles de permeabilidad que combina las características de distintos tipos de apósitos: pasivos, interactivos y otros componentes.
Clasificación: Antimicrobianos desodorantes.
Absorbentes.
Los apósitos primarios son aquellos que están en contacto directo con el lecho de la herida. De acuerdo a la Orientación Técnica de Manejo Integral del Pie Diabético del MINSAL, los apósitos primarios se describirán para úlcera de pie diabético con colonización baja y exudado escaso, colonización baja con exudado moderado a abundante, colonización crítica con exudado moderado a abundante (apósitos bacteriostáticos), apósitos secundarios y fijación.
Apósitos primarios en colonización baja con exudado escaso:
Hidrogel: Los apósitos de hidrogel contienen una gran cantidad de agua y polímeros espesantes y humectantes que mantiene las úlceras húmedas en lugar de permitir que se sequen ya que las heridas húmedas cicatrizan más rápidamente que las heridas secas.
- Indicación: Heridas secas con exudado bajo- nulo.
- Efectos: Rehidrata el lecho de la herida. Controla humedad. Promueve desbridamiento autolítico. Enfría.
- Forma de uso: aplicar sobre el lecho de la herida y cubrir con tull o transparente no adhesivo para que el apósito pasivo no absorba el gel.
- Frecuencia de cambio: puede permanecer en el lecho hasta 3 días
Tull de silicona: lámina de contacto porosa, transparente o semitransparente, microadherente, perforada compuesta de silicio y oxígeno. No interfiere con la gestión del exudado. Se puede usar hasta 7 días.
Apósito transparente no adhesivo: compuesto de nylon o poliéster. Se usa sobre tejido granulatorio en la última fase del proceso de cicatrización como protección. No se debe usar con adhesivo ya que son contraproducentes en heridas isquémicas o neuroisquémicas. Tiempo máximo de uso: 7 días.
Inhibidor de las Metaloproteasas: consiste en una matriz liofilizada, estéril, porosa y absorbente. Compuesta por colágeno y celulosa. También existen a base de Nano-Oligosacáridos o de Etilendiamintetracético (EDTA). Tiempo máximo de uso 3 a 4 días.
Colágeno: el más usado es el colágeno tipo 1 que se extrae de la piel de animales o de tendones. Contribuyen con la mejora del depósito de colágeno y tienen efecto hemostático. Tiempo máximo de uso 3 a 4 días.
Apósitos primarios en colonización baja con exudado moderado a abundante
- Alginatos: Polisacáridos naturales de fibra no tejida derivados de la sal de calcio del ácido algínico (presente en las algas). Compuestos por iones Sodio y Calcio. Disponibles en láminas y mechas. Se usan en heridas con exudación moderada a abundante. Al entrar en contacto con la herida forman un gel. Tienen efecto hemostático. Algunos algunos alginatos se combinan con Carboximetilcelulosa (CMC) para incrementar su poder de absorción. Tiempo máximo de uso 3 días.
- Carboximetilcelulosa (CMC): polisacárido de elevado peso molecular. Cuando entra en contacto con el exudado acidifica el pH. También forma un gel y posee alta capacidad de absorción. Tiempo máximo de uso: 3 días.
- Espumas hidrofílicas no adhesivas: compuestas de poliuretano. Atraen el agua. Existen de 2 o más capas. Es un apósito no adherente al tejido, a base de poliuretano (atraen el agua).
Se utilizan para absorber fluidos de moderado a abundante cuantía
Disponibles en láminas, cojincillos y mechas. Existen gruesas y delgadas lo que determina su poder de absorción. Son con adhesivo o sin adhesivo. Algunas traen silicona o hidrogel que causan menos trauma en la lesión. Tiempo máximo uso: 3 días.
Espumas en láminas : Son de diferente espesor y superficie. Según su estructura pueden ser unilaminares, bilaminares, trilaminares o o tetralaminares.
Unilaminar: formada por una espuma de poliuretano hidrofílica.
- Bilaminar: formada por película de poliuretano externa y una espuma de gel de poliuretano hidrofílica que queda en contacto con la herida y actúa absorbiendo el fluido.
Trilaminar: La capa interna va en contacto con la herida, constituida por una red de poliuretano en forma de celdilla macro o microscópicas, una central de poliuretano hidrofílico y una película exterior de poliuretano. - Tetralaminar: va en contacto con la herida una almohadilla central de poliuretano que tiene en su interior una capa de gasa no tejida, alrededor presenta una capa adhesiva de gel de poliuretano y una capa exterior de poliuretano permeable al vapor de agua e impermeable al agua.
EVALUACIÓN DEL APÓSITO: ayuda a orientar la elección del apósito
| ¿Se Mantiene intacto y en su lugar durante todo el tiempo de uso?¿Evita la fuga de exudado entre los cambios de apósito?¿Causa maceración/alergia o sensibilidad?¿Reduce el dolor?¿Retiene líquido (p. ej., bajo compresión)?¿Atrapa componentes del exudado (es decir, bloqueo)? | ¿Cómodo, adaptable, flexible y de un volumen/peso que no dificulta la actividad física? ¿Adecuado para dejarlo puesto durante un tiempo prolongado? ¿Fácil de retirar (no traumatiza la piel circundante ni el lecho de la herida)? ¿Fácil de usar? ¿coste-efectivo? |
E: Control de los bordes y piel perilesional
La cicatrización ocurre desde los bordes hacia el centro de la úlcera por migración de las células epiteliales. El manejo y la protección de los bordes y de la piel perilesional es esencial para contribuir con el proceso de cicatrización.
¿Problemas?
Problemas en los bordes y piel perilesional son muy frecuentes y causan retardo en el proceso de cicatrización, dolor, incrementan el tamaño de la herida y afecta enormemente la calidad de vida del paciente y su bienestar. La cantidad de exudado en el factor clave que incrementa el riesgo de lesión de los bordes y de la piel perilesional.
La excesiva cantidad de exudado, altera la función del estrato córneo. La humedad cambia el pH de la piel y esto altera el funcionamiento de la piel al alterar el mato lipídico de la piel. Esto genera alto riesgo de desarrollar dermatitis perilesional. Eritema y edema pueden indicar infección la que debe ser tratada como señalamos anteriormente. La piel perilesional también debería ser evaluada en busca de otros problemas.
| Maceración | Escoriación | Deshidratación | Hiperqueratosis | Callos | Eccema |
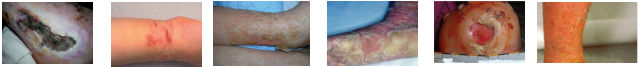
Recomendaciones manejo de los bordes y piel perilesional :
- Manejo del exudado (manejar la causa, elección correcta del apósito)
- Evitar la maceración o deshidratación de los bordes y de la piel perilesional (dermatitis perilesional)
- Hidratar bordes de la herida: Utilizar hidratantes y protectores cutáneos de silicona. Estos últimos impiden que el exudado macere los bordes y piel perilesional. También facilitan la adherencia de los apósitos.
- Mantener bordes y piel perilesional limpios y secos
- Técnica de curación que cause el menor trauma químico y mecánico. No friccionar
- Aplique un producto barrera (silicona transparente. Las pastas en base a oxido de zinc ya no están recomendadas porque impiden valorar la piel y retirarlas resulta muy complicado)
- Seleccionar y aplicar vendaje apropiado para proteger la lesión y la piel circundante de la fricción, cizallamiento, presión y trauma físico o químico y de gestionar el exudado y evitar que se seque la úlcera, herida o maceración
- Si hay dermatitis perilesional infectada el Instituto Nacional de Heridas (INH Chile) en la Orientación Técnica para Manejo Integral de la UPD, recomienda aplicar crema con ácido fusídico en combinación con un corticoide y cubrir con un tull a fin de que el producto no sea absorbido por el apósito pasivo o por el vendaje. El ácido fusidico es un bacteriostático que no provoca la muerte bacteriana, pero si impide su reproducción. Las cremas con corticoides no pueden aplicarse por más de 10 días.
Extraído de: Cura en ambiente húmedo en úlceras crónicas a través del Concepto TIME. Recomendaciones basadas en la evidencia. https://anedidic.com/descargas/trabajos-de-investigacion/20/cura-en-ambiente-humedo-y-concepto-time.pdf
Clasificación de los hidratantes:
(Esquema elaborado por EU. Sandra Guerrero Universidad Nacional de Colombia)
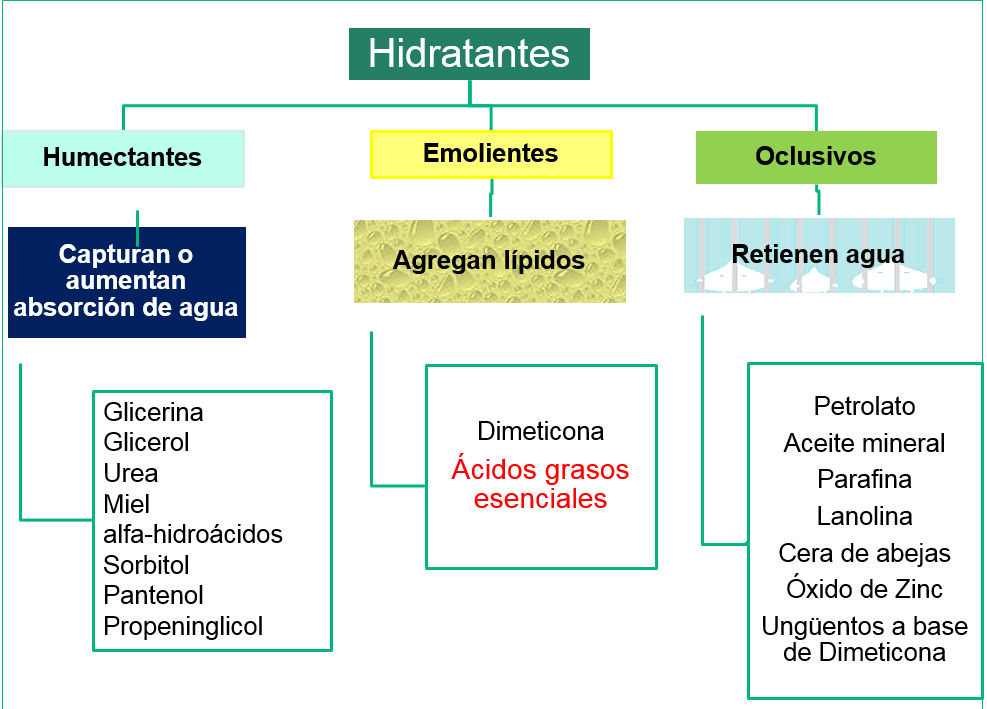
HIDRATANTES: se pueden clasificar en humectantes, emolientes y oclusivos. Pueden contener aminoácidos, ácido hialurónico, lactato de sodio, sorbitol, urea.
HUMECTANTES: Las cremas humectantes contienen agentes como la glicerina o el propelinglicol u otros y son capaces de restituir el agua pérdida. Capturan o aumentan la absorción de agua.
EMOLIENTES: Son aquellos que aportan lípidos a la piel necesarios para mantener la función de barrera del estrato córneo. Como ya se ha mencionado, los lípidos son necesarios para mantener la estructura y buen funcionamiento del estrato córneo. Proporcionan resistencia y flexibilidad a la piel a la vez que disminuyen el picor. Los ácidos grasos hiperoxigenados (AGHO) estarían dentro de la categoría de emolientes, estos actúan a nivel de la epidermis y dermis.
OCLUSIVOS: son pastas, cremas o pomadas. Muy conocidas en el tratamiento de las heridas son el petrolato (vaselina) y el óxido de zinc (pasta lassar). Los agentes oclusivos están siendo menos recomendados, debido a que impiden la respiración de la piel y por ejemplo el óxido de zinc es muy difícil de retirar sin dañar el estrato córneo.
Recomendaciones en protección de piel
| Tipo de piel | Protector | Producto |
| Piel sana menor de 30 años | Humectantes | Glicerina |
| Piel sana mayor de 30 años | Hidratantes simples | Ureas |
| Piel descamada pigmentada | Hidratantes complejos | AGHO |
| Piel macerada eritematosa | Protector cutáneo | Silicona |
IMPORTANTE: Valorar el impacto y la eficacia del plan de tratamiento
